Streptococcus pyogenes (Streptococco di gruppo A) è una delle più importanti cause batteriche di infezioni della pelle e dei tessuti molli (SSTI) in tutto il mondo. Nessun altro patogeno causa tante entità cliniche come S. pyogenes.
In particolare, questo organismo causa infezioni nello strato superficiale formato da cheratina (impetigine), nell'epidermide superficiale (erisipela), nel tessuto sottocutaneo (cellulite), nella fascia (fascite necrotizzante) o nel muscolo (miosite e mionecrosi).
Inoltre, è anche l'agente eziologico della scarlattina e della sindrome da shock tossico da streptococco (StrepTSS).
L'impetigine è un'infezione non pericolosa per la vita, ma può causare glomerulonefrite acuta post-streptococcica (AGN).
La cellulite e l'erisipela possono essere lievi o moderatamente gravi, mentre la fascite necrotizzante, la mionecrosi e lo Strep TSS sono pericolose per la vita.
Questo capitolo si concentra sulle caratteristiche cliniche ed epidemiologiche di queste infezioni, nonché sulle opzioni terapeutiche, e include una discussione sulla patogenesi batterica.
Relazione anatomica delle infezioni della pelle e della sua struttura con S. pyogenes
La comprensione dell'anatomia degli strati cutanei è fondamentale per il medico per stabilire una diagnosi corretta delle infezioni streptococciche della cute e dei tessuti molli.
La Figura 1 illustra la relazione tra diverse strutture anatomiche e i tipi di infezioni da S. pyogenes che colpiscono strati specifici della pelle e tessuti più profondi (da Stevens, 2015).
Si noti che l'impetigine coinvolge lo strato esterno di cheratina della pelle, che si traduce in lesioni crostose, mentre l'erisipela colpisce l'epidermide superficiale, che si traduce in bordi ben delimitati dell'infezione e un colore della pelle rosso brillante. La cellulite si verifica nei tessuti sottocutanei più profondi e ha una tonalità rosata con bordi meno definiti.
Fascite necrotizzante causata da S. pyogenesè stata definita dai chirurghi come un'infezione che coinvolge la fascia superficiale o profonda, in associazione con distruzione di tessuto. In realtà, la fascite necrotizzante nelle sue fasi successive coinvolge anche tutti gli strati della pelle e dei muscoli.
L'infezione muscolare da S. pyogenes può assumere due forme, miosite o mionecrosi.
La miosite non è solitamente associata a necrosi ed è più comunemente causata da Staphylococcus aureus.
Mionecrosi da S. pyogenesè un'infezione aggressiva, spesso pericolosa per la vita, che può svilupparsi in qualsiasi ferita aperta o per disseminazione ematogena del muscolo che è stato danneggiato da un semplice stiramento o da un altro tipo di trauma non penetrante (come una contusione).
Quest'ultima infezione è stata chiamata mionecrosi criptogenetica o spontanea ed è associata a mortalità fino all'80%. Si noti l'intima relazione dell'afflusso di sangue allo strato muscolare.
Con il progredire della mionecrosi, l'afflusso di sangue viene compromesso, con conseguente comparsa di bolle violacee violacee, emorragia nella pelle e rapida progressione della distruzione dei tessuti.
Vedere il capitolo sulle infezioni invasive da S. pyogenes per ulteriori discussioni sulla patogenesi della fascite necrotizzante e della mionecrosi.
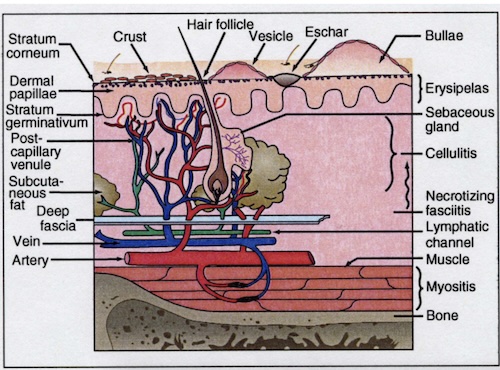
Figura 1. Relazione anatomica tra pelle e strutture cutanee e diverse infezioni da S. pyogenes . Da Harrison's Principals of Internal Medicine, 19 a edizione, e utilizzato con autorizzazione (Stevens, 2015).
La Figura 2 mostra un algoritmo di trattamento preparato per le linee guida della Infectious Diseases Society of America del 2014 per la diagnosi e la gestione delle infezioni della pelle e dei tessuti molli (SSTI) (Stevens, et al., 2014).
Le infezioni purulente dei tessuti molli sono più comunemente causate da specie stafilococciche, mentre la cellulite da streptococco di gruppo A, l'erisipela, la fascite necrotizzante e la mionecrosi non sono purulente.
Una volta che il medico ha fatto questa distinzione, la decisione successiva è determinare se i segni, i sintomi e gli esami di laboratorio del paziente indicano un'infezione lieve, moderata o grave. Per ciascuna categoria vengono poi forniti approcci diagnostici e terapeutici appropriati.
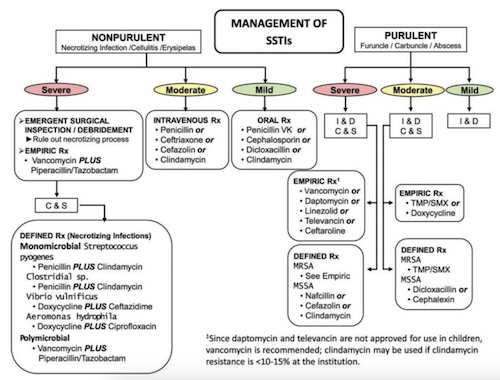
Figura 2. Algoritmo per la gestione delle infezioni della pelle e dei tessuti molli. Da Clinical Infectious Diseases, 2014, e utilizzato con autorizzazione (Stevens, et al., 2014).
Piodermite streptococcica
Piodermite, impetigine e impetigine contagiosa sono termini usati come sinonimi per descrivere lesioni purulente discrete che sono infezioni primarie della pelle e che sono estremamente diffuse in molte parti del mondo.
Nella grande maggioranza dei casi, la piodermite è causata da streptococchi β-emolitici, Staphylococcus aureus o entrambi .
Epidemiologia
Il numero di casi esistenti di piodermite streptococcica nei bambini di età inferiore ai 15 anni è stimato a 111 milioni (Carapetis, Steer, Mulholland e Weber, 2005). In particolare, questa cifra esclude i casi negli adulti e quelli negli adulti e nei bambini nei paesi sviluppati.
L'incidenza di questa malattia è notevolmente influenzata da diversi fattori, i più importanti dei quali sembrano essere il clima e l'igiene, entrambi paralleli alle disuguaglianze socio-economiche globali tra paesi sviluppati (latitudini settentrionali, climi temperati) e paesi in via di sviluppo (latitudini equatoriali, climi tropicali/subtropicali).
Pertanto, il carico globale maggiore di questa infezione si riscontra nei bambini economicamente svantaggiati nei climi tropicali o subtropicali, sebbene sia prevalente anche nei climi settentrionali durante i mesi estivi (Ferrieri, Dajani, Wannamaker e Chapman, 1972).
Il picco di incidenza dell'impetigine è nei bambini di età compresa tra 2 e 5 anni, ma può verificarsi anche tra i bambini più grandi e gli adulti le cui attività ricreative o occupazioni provocano tagli o abrasioni cutanee (Adams, 2002; Fehrs, et al., 1987 ; Wasserzug , et al., 2009). Non c'è una particolare predilezione di genere e tutte le razze sembrano essere suscettibili.
Meticolosi studi prospettici sull'impetigine streptococcica hanno dimostrato che i microrganismi responsabili inizialmente colonizzano la cute integra (Ferrieri, Dajani, Wannamaker, & Chapman, 1972), un'osservazione che probabilmente spiega l'influenza dell'igiene personale sull'incidenza delle malattie.
Lo sviluppo della colonizzazione cutanea con un dato ceppo streptococcico precede lo sviluppo di lesioni impetiginose di un intervallo medio di 10 giorni.
Il meccanismo di produzione delle lesioni cutanee non è provato, ma molto probabilmente è causato dall'inoculazione intradermica di organismi superficiali da abrasioni, traumi minori o punture di insetti.
Frequentemente, vi è un trasferimento dei ceppi streptococcici dalle lesioni cutanee e/o piodermite al tratto respiratorio superiore. L'intervallo tra la colonizzazione della pelle e la colonizzazione del naso e/o della gola è in media di 2-3 settimane.
La scabbia è anche molto diffusa nelle comunità socialmente svantaggiate, come le popolazioni indigene e nei paesi in via di sviluppo.
La sua associazione con la piodermite streptococcica di gruppo A è ben consolidata e il trattamento della scabbia riduce chiaramente la prevalenza della successiva infezione batterica.
Tuttavia, tali infestazioni possono fare di più che fornire semplicemente un portale di ingresso batterico nella pelle.
Un recente studio molecolare di Mika e colleghi ha dimostrato che i composti intestinali escreti dall'acaro della scabbia hanno potenti funzioni inibitorie del complemento che promuovono la crescita dello streptococco di gruppo A, anche in presenza di anticorpi specifici del tipo (Mika, et al., 2012).
Questi risultati forniscono il primo meccanismo molecolare per spiegare la ben nota associazione tra scabbia e piodermite streptococcica e suggeriscono nuovi bersagli per l'intervento.
Batteriologia e immunologia
Gli streptococchi isolati dalle lesioni piodermiche sono principalmente di gruppo A, ma occasionalmente sono responsabili altri sierogruppi, come i ceppi C e G. S. pyogenes che causano l'impetigine e differiscono per diversi aspetti da quelli solitamente associati a tonsillite e faringite.
I ceppi cutanei appartengono a diversi sierotipi M ea diversi modelli di genotipo emm rispetto ai classici ceppi faringei (recensiti in (Bessen, 2009).
Ad esempio, tra i 3 principali genotipi di pattern emm , (vale a dire AC, D ed E), il gruppo AC con pattern emm ha una forte predilezione a causare infezione della gola, e i ceppi con pattern Emm D hanno una forte tendenza a causare impetigine (Bessen, 2009).
Al contrario, i ceppi con pattern E sono designati come generalisti che causano prontamente infezioni in entrambi i siti tissutali (Anthony, Kaplan, Wannamaker e Chapman, 1976).
Pertanto, i ceppi di S. pyogenes possono essere suddivisi in 3 gruppi clinicamente ed ecologicamente rilevanti, in base al loro genotipo con pattern emm.
A parte le differenze di emm , i ceppi della gola e della pelle possono anche essere differenziati da altri marcatori genetici (Fiorentino, Beall, Mshar, & Bessen, 1997) e tratti funzionali, comprese le differenze nella loro avidità di legame per i cheratinociti.
Poiché la maggior parte dei ceppi cutanei sono stati identificati più di recente, tendono ad essere costituiti dai tipi M con numero più alto.
Il classico ceppo cutaneo associato all'impetigine e all'AGN post-streptococcico è il ceppo M-49, che è stato isolato a Red Lake, Minnesota.
Manifestazioni cliniche e diagnosi
La lesione della piodermite streptococcica inizia come una papula che evolve rapidamente in una vescicola, circondata da un'area di eritema.
Le lesioni vescicolari sono evanescenti e raramente riconosciute clinicamente; danno origine a pustole che gradualmente si allargano e poi si rompono in un periodo da 4 a 6 giorni per formare caratteristiche croste spesse.
Le lesioni guariscono lentamente e lasciano aree depigmentate. Una forma di impetigine profondamente ulcerata è nota come ectima.
L'impetigine streptococcica si verifica sulle aree esposte del corpo, più frequentemente sulle estremità inferiori o sul viso. Le lesioni rimangono ben localizzate, ma spesso compaiono in multipli. Sebbene possa verificarsi linfoadenite regionale, i sintomi sistemici non sono normalmente presenti.
In passato, le lesioni precedentemente descritte potevano essere diagnosticate con sicurezza come streptococciche. Questa era la forma predominante di impetigine, che poteva essere distinta dall'impetigine bollosa causata dal gruppo fagico II S. aureus.
Sebbene l'impetigine bollosa rimanga causata quasi esclusivamente dallo stafilococco, la batteriologia dell'impetigine non bollosa è cambiata (Barnett & Frieden, 1992). S. aureus , da solo o in combinazione con S. pyogenes, è ora l'agente eziologico predominante (Gonzalez, et al., 1989). Quasi tutti questi stafilococchi sono produttori di penicillinasi.
Pertanto, il trattamento con penicillina, che in precedenza era stato altamente efficace contro l'impetigine non bollosa, anche quando sia gli streptococchi che gli stafilococchi erano stati isolati dalle lesioni, ora frequentemente fallisce (Demidovich, Wittler, Ruff, Bass e Browning, 1990).
I dosaggi degli anticorpi anti-streptolisina O (ASO) non hanno alcun valore nella diagnosi e nella gestione dell'impetigine, perché la risposta ASO è debole nei pazienti con impetigine streptococcica (Kaplan, Anthony, Chapman, Ayoub, & Wannamaker, 1970 ; Bisno, Nelson , Waytz, & Brunt, 1973), presumibilmente perché l'attività della streptolisina O è inibita dai lipidi cutanei (colesterolo) (Kaplan & Wannamaker, 1976).
Al contrario, i livelli di anti-DNasi B sono elevati (Kaplan, Anthony, Chapman, Ayoub, & Wannamaker, 1970 ; Bisno, Nelson, Waytz, & Brunt, 1973) e quindi forniscono utili prove a supporto di una recente infezione streptococcica in pazienti che sono sospettati di avere una glomerulonefrite post-streptococcica.
Trattamento e prevenzione
A causa dell'attuale frequenza di isolamento di S. aureus da lesioni impetigine non bollose e segnalazioni concomitanti di fallimenti della penicillina (Demidovich, Wittler, Ruff, Bass, & Browning, 1990 ; Dagan & Bar-David, 1989 ; Barton & Friedman, 1987), sono preferite le penicilline penicillinasi-resistenti o le cefalosporine di prima generazione (Demidovich, Wittler, Ruff, Bass, & Browning, 1990).
L'eritromicina è stata a lungo un pilastro della terapia della piodermite, ma il suo uso è controindicato nelle aree in cui sono prevalenti ceppi di S. aureus resistenti all'eritromicina o, più recentemente, S. pyogenes.
La terapia topica con mupirocina è equivalente agli agenti antimicrobici sistemici orali (Barton, Friedman, Sharkey, Schneller e Swierkosz, 1989 ; Britton, Fajardo, & Krafte-Jacobs, 1990 ), e può essere utilizzato quando le lesioni sono in numero limitato.
Tuttavia, è costoso e alcuni ceppi di stafilococchi possono essere resistenti (Yun, et al., 2003).
La retapamulina, un nuovo antibatterico pleuromutilina, e la crema di ozenoxacina all'1%, un antibiotico chinolonico, sono stati recentemente approvati dalla FDA per il trattamento dell'impetigine bollosa e non bollosa causata da S. pyogenes e ceppi sensibili alla meticillina di S. aureus nei bambini 9 mesi di età o più (Yang & Keam, 2008).
I dati in vitro hanno suggerito che questi agenti possono essere più efficaci della mupirocina contro la resistenza alla meticillinaStafilococco aureo (MRSA).
Migliori condizioni di vita, migliore igiene personale e trattamento topico delle lesioni impetiginose possono prevenire la diffusione dell'impetigine a soggetti sensibili.
Inoltre, un recente studio molecolare ha fornito la prova che le proteine dell'acaro della scabbia agiscono come inibitori del complemento e migliorano la crescita di S. pyogenes nelle analisi del sangue intero, presumibilmente mediante l'inibizione dell'immunità innata dell'ospite.
Sulla base di questi dati di base, ipotizziamo che le funzioni inibitorie del complemento delle molecole intestinali escrete promuovano la crescita di agenti patogeni batterici nel microambiente delle tane epidermiche.
Complicazioni
Le complicanze suppurative sono rare, ma le infezioni cutanee da ceppi nefritogeni di S. pyogenes predispongono i pazienti all'AGN post-streptococcico in molte aree del mondo.
Non ci sono ancora dati conclusivi che indichino che il trattamento di un singolo caso di piodermite prevenga la successiva comparsa di nefrite in questi pazienti.
Tale terapia è tuttavia importante come misura epidemiologica per l'eradicazione dei ceppi nefritogeni dall'ambiente. Per ragioni non ancora spiegate, la febbre reumatica non è mai stata dimostrata dopo la piodermite streptococcica.
Erisipela
Gli streptococchi furono dimostrati per la prima volta in casi di erisipela e infezioni di ferite da Billroth nel 1874 e nel sangue di un paziente con sepsi puerperale da Pasteur nel 1879. coltura dalle lesioni dell'erisipela e poi dimostrato che questi organismi potrebbero indurre la tipica erisipela nell'uomo. Rosenbach applicò a questi organismi la designazione Streptococcus pyogenes nel 1884.
Nel 1938 Lancefield diede loro la distinzione di streptococco di gruppo A.
L'erisipela è un processo cutaneo superficiale che di solito è limitato al derma, ma con un coinvolgimento linfatico prominente.
Si distingue clinicamente da altre forme di infezione cutanea per tre caratteristiche:
- le lesioni sono sollevate al di sopra del livello della pelle circostante,
- c'è una chiara linea di demarcazione tra il tessuto interessato e quello non coinvolto
- le lesioni sono di un brillante colore rosso salmone.
Questo disturbo è più comune nei neonati, nei bambini piccoli e negli anziani ed è quasi sempre causato da streptococchi β-emolitici.
Nella maggior parte dei casi, l'agente infettante è S. pyogenes, ma lesioni simili possono essere causate da streptococchi di gruppo C o G. Raramente, streptococchi di gruppo B o S. aureuspotrebbero essere i colpevoli.
Nei rapporti più vecchi, l'erisipela è stata descritta come caratteristica che coinvolge l'area del viso a farfalla, ma al momento le estremità inferiori sono più frequentemente coinvolte.
Nei pazienti con erisipela facciale, c'è spesso una storia di precedente mal di gola da streptococco, sebbene l'esatta modalità di diffusione alla pelle sia sconosciuta.
Quando l'erisipela coinvolge le estremità, le rotture nella barriera cutanea fungono da portali di ingresso; questi includono incisioni chirurgiche, traumi o abrasioni, malattie dermatologiche (come la psoriasi) o infezioni fungine locali.
La lesione cutanea inizia come un'area localizzata di eritema e tumefazione e poi si diffonde rapidamente con l'avanzare dei margini rossi, che sono rilevati e ben delimitati dal tessuto normale adiacente.
C'è un edema marcato, spesso con formazione di vescicole, e nell'erisipela facciale, gli occhi sono spesso chiusi e gonfi. La lesione può dimostrare una risoluzione centrale pur continuando ad estendersi alla periferia.
L'infiammazione cutanea è accompagnata da brividi, febbre e tossicità. L'erisipela ricorrente è stata segnalata per il 16% in Cina con chirurgia, obesità, diabete mellito, insufficienza venosa e linfedema considerati i principali fattori di rischio per la recidiva (Li, Wang, Ge, Xin e Li, 2021).
La diagnosi differenziale è limitata. All'inizio, le lesioni dell'herpes zoster facciale, della dermatite da contatto o dell'orticaria gigante possono essere confuse con l'erisipela.
Nei pazienti con febbre mediterranea familiare possono verificarsi lesioni che ricordano l'erisipela. Lesioni cutanee simili nell'aspetto a quelle dell'erisipela possono verificarsi sulle mani di pazienti che subiscono tagli o abrasioni mentre maneggiano pesce o carne.
Questa entità, nota come erisipeloide di Rosenbach e causata da Erysipelothrix rhusiopathiae , di solito non è accompagnata da febbre o sintomi sistemici.
Con diagnosi e trattamento precoci, la prognosi è eccellente. Raramente, tuttavia, il processo può diffondersi a livelli più profondi della pelle e dei tessuti molli.
La penicillina, per via parenterale o orale, a seconda della gravità clinica, è il trattamento di scelta. Se si sospetta un'infezione da stafilococco, deve essere selezionata una penicillina o cefalosporina semisintetica resistente alla penicillinasi.
In uno studio multicentrico prospettico randomizzato (Bernard, et al., 1992), la roxitromicina, un antimicrobico macrolide, era equivalente alla penicillina.
Tuttavia, in alcune aree degli Stati Uniti sono stati rilevati livelli aumentati di resistenza ai macrolidi tra S. pyogenes (Martin, Green, Barbadora, & Wald, 2002; York, Gibbs, Perdreau-Remington, & Brooks, 1999) e la resistenza alla clindamicina sta emergendo in tutto il mondo tra i ceppi invasivi e non invasivi di S. pyogenes (Stevens, Bryant e Goldstein, 2021).
Cellulite streptococcica
La cellulite streptococcica, un'infiammazione acuta diffusa della pelle e dei tessuti sottocutanei, di solito deriva dall'infezione di ustioni, ferite o incisioni chirurgiche, ma può anche seguire un trauma lieve.
I reperti clinici comprendono:
- dolore locale,
- dolorabilità,
- tumefazione ed eritema.
Il processo può estendersi rapidamente fino a coinvolgere vaste aree della pelle. Le manifestazioni sistemiche comprendono febbre, brividi e malessere e possono essere associate linfangite, batteriemia o entrambe.
Contrariamente all'erisipela, la lesione non è sollevata, la demarcazione tra pelle coinvolta e non coinvolta è indistinta e le lesioni sono di colore più rosa che rosso salmone. Spesso, tuttavia, la differenziazione clinica tra queste entità non è netta.
Due cause predisponenti della cellulite streptococcica meritano una menzione speciale. Uno è l'iniezione parenterale di droghe illecite (Lentnek, Giger, & O'Rourke, 1990 ; Barg, Kish, Kauffman, & Supena, 1985).
Questi casi sono spesso associati a batteriemia e infezioni dei tessuti profondi, come tromboflebite settica, artrite suppurativa, osteomielite e occasionalmente endocardite infettiva.
In secondo luogo, i pazienti che hanno un drenaggio linfatico compromesso dagli arti superiori o inferiori sono soggetti a episodi ricorrenti di cellulite streptococcica.
Gli esempi includono individui con filariosi e donne sottoposte a mastectomia radicale con dissezione del linfonodo ascellare (Simon & Cody, 1992).
Si ipotizza che l'infezione ripetuta danneggi ulteriormente i vasi linfatici locali e peggiori la stasi linfatica (de Godoy, de Godoy, Valente, Camacho e Paiva, 2000).
Episodi ricorrenti di cellulite grave sono stati riportati anche in alcuni pazienti sottoposti a bypass coronarico (Baddour & Bisno, 1982).
La lesione si verifica invariabilmente nell'estremità da cui è stata rimossa la vena safena e, a volte, può presentare caratteristiche di erisipela.
I pazienti con tinea pedis dell'arto venectomia sembrano essere particolarmente a rischio (Baddour & Bisno, 1984 ; Semel & Goldin, 1996).
Come con altre forme di cellulite, i batteri patogeni sono difficili da recuperare durante questi episodi, ma l'aspetto delle lesioni e la risposta alla terapia con penicillina suggeriscono una causa streptococcica.
I pochi streptococchi β-emolitici che sono stati recuperati e caratterizzati spesso appartengono a sierogruppi diversi dal gruppo A (Baddour & Bisno, 1985).
La rottura della barriera cutanea (ulcere delle gambe, ferite, dermatofitosi) è un fattore di rischio per lo sviluppo dell'infezione cutanea da streptococco (Dupuy, et al., 1999).
Esistono prove suggestive che l'infezione locale da dermatofiti (come il piede d'atleta) possa fungere da serbatoio per streptococchi β-emolitici che danno inizio a episodi di erisipela o cellulite degli arti inferiori (Semel & Goldin, 1996; Roldan, Mata-Essayag , & Hartung , 2000).
Pertanto, occorre prestare attenzione per sradicare tali infezioni fungine nei pazienti che soffrono di attacchi ricorrenti di erisipela o cellulite. Un altro potenziale serbatoio è la colonizzazione streptococcica anale (Eriksson BK, 1999).
Altri fattori di rischio includono insufficienza venosa, edema e obesità.
Un aumento del rischio di cellulite ricorrente è stato associato a una mancanza di igiene dei piedi ed è stato riportato anche nei senzatetto (Lewis, Peter, Gómez-Marín e Bisno, 2006).
La cellulite può essere causata dall'infezione con una varietà di patogeni batterici, ma la maggior parte dei casi è causata da S. pyogenes (o, occasionalmente, streptococchi di gruppo B, C o G) o da S. aureus. S.aureus, l'infezione della pelle è solitamente associata a un focolaio piogenico e fluttuante con eritema circostante ed è stata definita "cellulite purulenta"; tuttavia, un termine migliore sarebbe infezione purulenta della pelle e dei tessuti molli con eritema circostante.
In questi casi l'eritema è interamente dovuto alla risposta dell'ospite al focolaio purulento.
La pelle arrossata non è di per sé infetta, poiché di solito basta un semplice drenaggio e nessun antibiotico per risolvere l'infezione. In assenza di emocolture positive, presenti solo nel 5% dei casi di cellulite non purulenta, spesso non è possibile una diagnosi microbiologica specifica.
I campioni di aspirato o biopsia da siti di cellulite attiva sono utili quando positivi su striscio o coltura, ma sfortunatamente, tali campioni sono generalmente negativi nei pazienti adulti (Hook, et al., 1986 ; Howe, Eduardo Fajardo, & Orcutt, 1987 ; Newell & Norden, 1988).
Trattamento
In alcuni casi, può essere difficile distinguere lo streptococco dall'infezione della pelle e dei tessuti molli da stafilococco alla presentazione iniziale.
In questo caso, dovrebbe essere utilizzata una penicillina semisintetica resistente alla penicillinasi. Nei pazienti allergici alla penicillina può essere utilizzata una cefalosporina di prima generazione se l'ipersensibilità non è di tipo immediato.
Clindamicina, linezolid, vancomicina o omadaciclina (Abrahamian, et al., 2019) possono essere utilizzati in pazienti che manifestano ipersensibilità anafilattica agli antibiotici β-lattamici e questi agenti devono essere somministrati se si sospetta un'infezione da MRSA.
I pazienti con casi più lievi di cellulite streptococcica possono passare ai farmaci orali dopo una risposta iniziale favorevole alla terapia parenterale.
In locali con alti livelli di resistenza ai macrolidi/lincosamidi in S. pyogenes , potrebbe essere implementato un trattamento empirico con linezolid, tedizolid o omadaciclina.
Il ruolo della profilassi antimicrobica continua (Wang, et al., 1997 ; Sjöblom, Eriksson, Jorup-Rönström, Karkkonen, & Lindqvist, 1993 ; Kremer, Zuckerman, Avraham, & Raz, 1991) nei pazienti soggetti a frequenti recidive rimane incerto.
Al momento, tale profilassi sembra giustificata solo per i pazienti con episodi molto frequenti o gravi e non è stato stabilito un regime ottimale.
Altre infezioni streptococciche con manifestazioni cutanee
Complicanze suppurative dei tessuti molli a seguito di faringite streptococcica
L'infiammazione nella zona facciale indotta da un'infezione streptococcica acuta può interessare le strutture che sono direttamente contigue alla faringe o che drenano tale sito.
Tali complicanze relativamente rare includono: (Dajani, Taubert, Ferrieri, Peter e Shulman, 1995).
- cellulite peritonsillare,
- ascesso peritonsillare,
- ascesso retrofaringeo
- linfoadenite cervicale suppurativa,
- mastoidite,
- sinusite acuta,
- otite media.
Tuttavia, gli ascessi peritonsillari o retrofaringei contengono frequentemente una varietà di altra flora orale, compresi gli anaerobi, con o senza S. pyogenes . S. pyogenes è responsabile solo di una piccola minoranza di casi di otite media o sinusite.
Scarlattina
La scarlattina deriva dall'infezione con un ceppo streptococcico che elabora esotossine pirogeniche streptococciche (tossine eritrogeniche).
Sebbene questa malattia sia solitamente associata a infezioni faringee, può seguire infezioni streptococciche in altri siti, come infezioni della ferita o sepsi puerperale.
La sindrome clinica è simile per molti aspetti a quella associata a ceppi non tossigeni, ad eccezione del caratteristico rash di tipo scarlattina.
Questi ultimi devono essere differenziati da quelli degli esantemi virali, delle eruzioni da farmaci, della sindrome da shock tossico da stafilococco e della malattia di Kawasaki.
L'eruzione di solito appare il secondo giorno di malattia clinica come un diffuso rossore rosso, con molti punti di rosso più intenso che sbiancano alla pressione. Spesso si nota prima sulla parte superiore del torace e poi si diffonde al resto del tronco, del collo e delle estremità.
I palmi e le piante dei piedi sono risparmiati. Le pieghe della pelle del collo, delle ascelle, dell'inguine, dei gomiti e delle ginocchia appaiono come linee di un rosso più intenso (linee di Pastia).
Sono presenti petecchie sparse e il test di Rumpel-Leeds sulla fragilità capillare è positivo. L'occlusione delle ghiandole sudoripare conferisce alla pelle una consistenza carta vetrata, una scoperta particolarmente utile nei pazienti di carnagione scura.
Il viso appare arrossato, ad eccezione di un marcato pallore periorale. Oltre ai riscontri di faringite essudativa e tonsillite, i pazienti presentano un esantema caratterizzato da piccole macchie rosse ed emorragiche sui palati duri e molli.
La lingua è inizialmente ricoperta da un rivestimento bianco-giallastro, attraverso il quale si possono vedere le papille rosse (lingua fragola bianca).
Successivamente, il rivestimento scompare e la lingua assume un aspetto rosso muscoloso (lingua rossa fragola). L'eruzione cutanea svanisce nel corso di una settimana ed è seguita da un'estesa desquamazione che dura per diverse settimane. Una modesta eosinofilia può essere presente all'inizio del decorso della malattia.
Le forme gravi di scarlattina, associate a diffusione locale o ematogena dell'organismo (scarlattina settica) oa profonda tossiemia (scarlattina tossica), sono caratterizzate da febbre alta e marcata tossicità sistemica.
Il decorso può essere complicato da artrite, ittero e, molto raramente, idrope della colecisti. Tali forme gravi della malattia sono rare nell'era degli antibiotici.
Tuttavia, alla fine del 1800, la scarlattina era associata a mortalità del 20% a Chicago, New York e in Scandinavia.
Durante la guerra civile americana, epidemie di scarlattina chirurgica, chiamata anche "cancrena ospedaliera", si svilupparono tra i soldati dopo l'amputazione delle ferite.
Recentemente, nel 2011, in Cina, tra gennaio e luglio, si è verificata un'epidemia di 900 casi di scarlattina associata all'emm-12 ceppi di S. pyogenes, la maggior parte dei quali erano resistenti all'eritromicina e alla clindamicina (Luk, et al., 2012).
Linfangite
La linfangite può accompagnare la cellulite o può verificarsi dopo un'infezione cutanea clinicamente minore o inapparente.
La linfangite è facilmente riconoscibile dalla presenza di strie lineari rosse, tenere, dirette verso linfonodi regionali ingrossati, dolenti. È accompagnato da sintomi sistemici, come brividi, febbre, malessere e mal di testa.
Sepsi puerperale e infezione dei genitali
La sepsi puerperale segue l'aborto o il parto naturale quando gli streptococchi che colonizzano la volta vaginale o sono trasmessi dal personale medico invadono l'endometrio e le strutture circostanti, i vasi linfatici e il flusso sanguigno.
L'endometrite e la setticemia risultanti possono essere complicate da:
- cellulite pelvica,
- tromboflebite pelvica settica,
- peritonite,
- ascesso pelvico.
Questa malattia era associata a un'elevata mortalità nell'era pre-antibiotica. Anche le lacerazioni della parete vaginale durante il parto o le sedi dell'episiotomia possono essere infettate da S. pyogenes e possono causare cellulite del perineo o fascite necrotizzante.
Anche le specie clostridiche possono causare infezione necrotizzante in queste condizioni, ma possono essere distinte da S. pyogenes , perché quest'ultimo non produce gas.
La cellulite perianale da S. pyogenes e la vulvo-vaginite sono disturbi sintomatici ma benigni che colpiscono principalmente i bambini (Petersen, Kaltoft, Misfeldt, Schumacher, & Schønheyder, 2003 ; Mogielnicki, Schwartzman, & Elliott, 2000).
La presenza asintomatica di S. pyogenes nella vagina, nell'ano, nel cuoio capelluto o, raramente, nel tratto respiratorio superiore degli adulti è stata, tuttavia, la fonte di alcuni focolai di infezione streptococcica nosocomiale (Mastro, et al., 1990).
Fattori di virulenza streptococcica associati a SSTI
Adesine
Un certo numero di componenti streptococcici somatici svolgono ruoli critici nella prima fase della colonizzazione, vale a dire l'adesione alla superficie delle cellule epiteliali umane.
Sono stati descritti almeno 17 candidati all'adesione (Courtney, Hasty, & Dale, 2002 ; Hasty, Itzhak, Courtney, & Doyle, 1992), ma i più ampiamente studiati sono stati l'acido lipoteicoico (LTA), la proteina M e il legame alla fibronectina proteine.
Attraverso interazioni idrofobiche, l'LTA funge da adesina di "primo passo", che porta gli organismi a stretto contatto con le cellule ospiti e quindi consente ad altre adesine di promuovere legami ad alta affinità (Hasty, Itzhak, Courtney e Doyle, 1992).
Sebbene la proteina M non sembri promuovere l'adesione alle cellule epiteliali buccali o tonsillari umane (Ofek, Beachey, Jefferson e Campbell, 1975; Caparon, Stephens, Olsén, & Scott, 1991), media l'adesione ai cheratinociti cutanei attraverso l'attaccamento della regione di ripetizione C al cofattore CD46 della membrana dei cheratinociti (Okada, Pentland, Falk, & Caparon, 1994 ; Okada, Liszewski, Atkinson , & Caparon, 1995).
Le proteine di superficie di S. pyogenes che legano la fibronectina sono state ampiamente studiate e sono importanti per l'adesione sia alla gola che alla pelle.
Questi includono la proteina F1 (PrtF1) (Hanski & Caparon, 1992), nota anche come SfbI (proteina I legante la fibronectina streptococcica) (Talay, Valentin-Weigand, Jerlström, Timmis, & Chhatwal, 1992); e proteine correlate note come SbfII (Kreikemeyer, Talay, & Chhatwal, 1995), FBP54 (Courtney, Dale, & Hasty, 1996), proteina F2 (Jaffe, Natanson-Yaron, Caparon, & Hanski, 1996 ) e PFBB (Rocha & Fischetti, 1999).
Inoltre, è stato riportato che l'espressione di queste adesine è regolata dall'ambiente (Gibson, et al., 1995).
L'espressione della proteina F1 è potenziata in un ambiente ricco di O2 , mentre quella della proteina M è maggiore a pressioni parziali più elevate di CO2 (Caparon , Geist, Perez-Casal, & Scott, 1992).
Pertanto, teleologicamente, si potrebbe ipotizzare che l'organismo mostri la proteina F1 sulla sua superficie quando cerca di aderire alla superficie cutanea, ma esprima la proteina M nei tessuti più profondi, dove è più probabile che incontri cellule fagocitiche.
Esotossine
Durante il corso della crescita sia in vitro che in vivo, S. pyogenes elabora numerosi prodotti extracellulari, solo un numero limitato dei quali è stato ben caratterizzato. Sono state descritte due distinte emolisine.
La prima è la streptolisina O (SLO), un membro della famiglia delle citolisine che si legano al colesterolo (esaminata in (Alouf & Geoffroy, 1999). Come molti dei suoi membri della famiglia, SLO deriva il suo nome dalla sua labilità all'ossigeno.
È reversibilmente inibito dall'ossigeno e irreversibilmente inibito dal colesterolo.
Oltre alla sua capacità di lisare gli eritrociti, è tossico per una varietà di cellule e frazioni cellulari legate alla membrana, inclusi leucociti, piastrine, cellule endoteliali, fibroblasti dermici, lisosomi e cardiomiociti isolati di mammiferi e anfibi.
SLO è prodotto praticamente da tutti i ceppi di S. pyogenes (così come da molti streptococchi di gruppo C e G) ed è antigenico.
La misurazione degli anticorpi anti-SLO (ASO) nei sieri umani è utile come indicatore di una recente infezione da streptococco, ma è di minor valore nei pazienti con impetigine.
Altri prodotti extracellulari di S. pyogenes possono facilitare la liquefazione del pus e la diffusione degli streptococchi attraverso i piani tissutali caratteristici della cellulite streptococcica e della fascite necrotizzante.
Questi includono:
- quattro enzimi di degradazione dell'acido desossiribonucleico antigenicamente distinti (DNasi A, B, C e D);
- ialuronidasi, che degrada l'acido ialuronico presente nella sostanza fondamentale del tessuto connettivo;
- streptochinasi, che promuove la dissoluzione dei coaguli catalizzando la conversione del plasminogeno in plasmina;
- esotossina pirogenica streptococcica B (SpeB), che è una potente proteasi; e
- peptidasi C5a, che scinde specificamente la chemiotassina umana C5a nel sito di legame del PMNL (Ji, McLandsborough, Kondagunta, & Cleary, 1996 ;Wexler, Chenoweth e Cleary, 1985).
SpeB scinde anche le IgG legate a S. pyogenes , interferendo così con l'ingestione e l'uccisione da parte dei fagociti (Eriksson & Norgren, 2003).
Diversi membri della famiglia delle esotossine pirogene streptococciche (Spe) sono stati associati a StrepTSS, fascite necrotizzante e altre gravi infezioni da S. pyogenes.
Questa famiglia di superantigeni include le SpeA e SpeC codificate dal batteriofago (storicamente note come scarlattina tossine), così come la cisteina proteasi SpeB e molte delle esotossine pirogeniche più recentemente identificate, come il fattore mitogeno (MF e SpeF) e lo streptococco superantigene (SSA), come recensito in (Bisno, Brito, & Collins, 2003).
I superantigeni sono potenti immunostimolatori che causano la proliferazione clonale delle cellule T e la produzione spartiacque di citochine pro-infiammatorie che mediano la distruzione dei tessuti, lo shock e l'insufficienza d'organo.
Controllo genetico dei fattori di virulenza
Il controllo dell'espressione genica del fattore di virulenza nel tempo e in diverse condizioni ambientali dipende da molteplici sistemi genetici complessi e interconnessi (esaminati in (Bisno, Brito, & Collins, 2003).
Dei noti regolatori trascrizionali in S. pyogenes, i più intensamente studiati includono Mga (m ultiple virulence gene regulator of group A streptococcus) (McIver, 2009), Mry (M protein R NA y ield) (Perez-Casal, Caparon, & Scott, 1991), e un sistema di regolazione a due componenti noto come CsrRS (sintesi della capsula regulator, R esponse e S ensor componenti) (Levin & Wessels, 1998) o, in alternativa, come CovRS (c ontrol of v irulence genes) (Federle, McIver, & Scott, 1999), che reprime la sintesi dell'acido ialuronico capsula e diverse esotossine.
È stato anche dimostrato che il regolatore della proteinasi B (RopB) possiede molteplici polimorfismi che controllano la virulenza di S. pyogenes (Carroll, et al., 2011).
Riferimenti
-
Abrahamian F. M., Sakoulas G., Tzanis E., Manley A., Steenbergen J., Das A. F., et al. McGovern P. C. Omadacycline for acute bacterial skin and skin structure infections. Clinical Infectious Diseases. 2019 August 1;69 Suppl 1:S23–S32. [PMC free article] [PubMed]
-
Alouf, J. E., & Geoffroy, C. (1999). The Family of the Antigenically-Related, Cholesterol-Binding ("Sulphydryl-Activated") Cytolytic Toxins. In J. E. Alouf, & J. H. Freer (Eds.), The Comprehensive Sourcebook of Bacterial Protein Toxins, Second Edition (pp. 147-186). New York: Academic Press.
-
Anthony B. F., Kaplan E. L., Wannamaker L. W., Chapman S. S. The dynamics of streptococcal infections in a defined population of children: serotypes associated with skin and respiratory infections. American Journal of Epidemiology. 1976;104(6):652–666. [PubMed]
-
Baddour L. M., Bisno A. L. Recurrent cellulitis after saphenous venectomy for coronary bypass surgery. Annals of Internal Medicine. 1982;97(4):493–496. [PubMed]
-
Baddour L. M., Bisno A. L. Recurrent cellulitis after coronary bypass surgery. Association with superficial fungal infection in saphenous venectomy limbs. JAMA. 1984;251(8):1049–1052. [PubMed]
-
Baddour L. M., Bisno A. L. Non-group A beta-hemolytic streptococcal cellulitis: association with venous and lymphatic compromise. The American Journal of Medicine. 1985;79(2):155–159. [PubMed]
-
Barg N. L., Kish M. A., Kauffman C. A., Supena R. B. Group A streptococcal bacteremia in intravenous drug abusers. The American Journal of Medicine. 1985;78(4):569–574. [PubMed]
-
Barnett B. O., Frieden L. J. Streptococcal skin diseases in children. Seminars in Dermatology. 1992;11(1):3–10. [PubMed]
-
Barton L. L., Friedman A. D. Impetigo: a reassessment of etiology and therapy. Pediatric Dermatology. 1987;4(3):185–188. [PubMed]
-
Barton L. L., Friedman A. D., Sharkey A. M., Schneller D. J., Swierkosz E. M. Impetigo contagiosa III. Comparative efficacy of oral erythromycin and topical mupirocin. Pediatric Dermatology. 1989;6(2):134–138. [PubMed]
-
Bernard P., Plantin P., Roger H., Sassolas B., Villaret E., Legrain V., et al. Scheimberg A. Roxithromycin versus penicillin in the treatment of erysipelas in adults: a comparative study. British Journal of Dermatology. 1992;127(2):155–159. [PubMed]
-
Bessen D. E. Population biology of the human restricted pathogen, Streptococcus pyogenes. Infection, Genetics and Evolution. 2009;9(4):581–593. [PMC free article] [PubMed]
-
Bisno A. L., Brito M. O., Collins C. M. Molecular basis of group A streptococcal virulence. The Lancet Infectious Diseases. 2003;3(4):191–200. [PubMed]
-
Bisno A. L., Nelson K. E., Waytz P., Brunt J. Factors influencing serum antibody response in streptococcal pyoderma. Journal of Laboratory and Clinical Medicine. 1973;81(3):410–420. [PubMed]
-
Britton J. W., Fajardo J. E., Krafte-Jacobs B. Comparison of mupirocin and erythromycin in the treatment of impetigo. The Journal of Pediatrics. 1990;117(5):827–829. [PubMed]
-
Caparon M. G., Geist R. T., Perez-Casal J., Scott J. R. Environmental regulation of virulence in group A streptococci: transcription of the gene encoding M protein is stimulated by carbon dioxide. Journal of Bacteriology. 1992;174(17):5693–5701. [PMC free article] [PubMed]
-
Caparon M. G., Stephens D. S., Olsén A., Scott J. R. Role of M protein in adherence of group A streptococci. Infection and Immunity. 1991;59(5):1811–1817. [PMC free article] [PubMed]
-
Carapetis J. R., Steer A. C., Mulholland E. K., Weber M. The global burden of group A streptococcal diseases. The Lancet Infectious Diseases. 2005;5(11):685–694. [PubMed]
-
Carroll R. K., Shelburne S. A., Olsen R. J., Suber B., Sahasrabhojane P., Kumaraswami M., et al. Musser J. M. Naturally occurring single amino acid replacements in a regulatory protein alter streptococcal gene expression and virulence in mice. The Journal of Clinical Investigation. 2011;121(5):1956–1968. [PMC free article] [PubMed]
-
Courtney H. S., Dale J. B., Hasty D. I. Differential effects of the streptococcal fibronectin-binding protein, FBP54, on adhesion of group A streptococci to human buccal cells and HEp-2 tissue culture cells. Infection and Immunity. 1996;64(7):2415–2419. [PMC free article] [PubMed]
-
Courtney H. S., Hasty D. L., Dale J. B. Molecular mechanisms of adhesion, colonization, and invasion of group A streptococci. Annals of Medicine. 2002;34(2):77–87. [PubMed]
-
Dagan R., Bar-David Y. Comparison of amoxicillin and clavulanic acid (augmentin) for the treatment of nonbullous impetigo. American Journal of Diseases of Children. 1989;143(8):916–918. [PubMed]
-
Dajani A., Taubert K., Ferrieri P., Peter G., Shulman S. Treatment of acute streptococcal pharyngitis and prevention of rheumatic fever: a statement for health professionals. Pediatrics. 1995;96(4 Pt 1):758–764. [PubMed]
-
de Godoy J. M., de Godoy M. F., Valente A., Camacho E. L., Paiva E. V. Lymphoscintigraphic evaluation in patients after erysipelas. Lymphology. 2000;33(4):177–180. [PubMed]
-
Demidovich, C. W., Wittler, R. R., Ruff, M. E., Bass, J. W., & Browning, W. C. (1990). Impetigo. Current etiology and comparison of penicillin, erythromycin, and cephalexin therapies. American journal of diseases of children (1960), 144(12), 1313-1315. [PubMed]
-
Dupuy A., Benchiki H., Roujeau J.-C., Bernard P., Vaillant L., Chosidow O., et al. Bastuji-Garin S. Risk factors for erysipelas of the leg (cellulitis): case-control study. The BMJ. 1999;318:1591. [PMC free article] [PubMed]
-
Eriksson A., Norgren M. Cleavage of antigen-bound immunoglobulin G by SpeB contributes to streptococcal persistence in opsonizing blood. Infection and Immunity. 2003;71(1):211–217. [PMC free article] [PubMed]
-
Eriksson B. K. Anal colonization of group G beta-hemolytic streptococci in relapsing erysipelas of the lower extremity. Clinical Infectious Diseases. 1999;29(5):1319–1320. [PubMed]
-
Federle M. J., McIver K. S., Scott J. R. A response regulator that represses transcription of several virulence operons in the group A streptococcus. Journal of Bacteriology. 1999;181(12):3649–3657. [PMC free article] [PubMed]
-
Fehrs L. J., Flanagan K., Kline S., Facklam R. R., Quackenbush K., Foster L. R. Group A beta-hemolytic streptococcal skin infections in a US meat-packing plant. JAMA. 1987;258(21):3131–3134. [PubMed]
-
Ferrieri P., Dajani A. S., Wannamaker L. W., Chapman S. S. Natural history of impetigo. 1. Site sequence of acquisition and. The Journal of Clinical Investigation. 1972;51(11):2851–2862. [PMC free article] [PubMed]
-
Fiorentino T. R., Beall B., Mshar P., Bessen D. E. A genetic-based evaluation of the principal tissue reservoir for group A streptococci isolated from normally sterile sites. The Journal of Infectious Diseases. 1997;176(1):177–182. [PubMed]
-
Gahlawat G., Tesfaye W., Bushell M., Abrha S., Peterson G. M., Mathew C., et al. Thomas J. Emerging Treatment Strategies for Impetigo in Endemic and Nonendemic Settings: A Systematic Review. Clinical therapeutics. 2021 June;43(6):986–1006. [PubMed]
-
Gibson C., Fogg G., Okada N., Geist R. T., Hanski E., Caparon M. Regulation of host cell recognition in Streptococcus pyogenes. Developments in Biological Standardization. 1995;85:137–144. [PubMed]
-
Gonzalez A., Schachner L. A., Cleary T., Scott G., Taplin D., Lambert W. Pyoderma in childhood. Advances in Dermatology. 1989;4:127–141. [PubMed]
-
Hanski E., Caparon M. Protein F, a fibronectin-binding protein, is an adhesin of the group A streptococcus Streptococcus pyogenes. Proceedings of the National Academy of Sciences of the United States of America. 1992;89(13):6172–6176. [PMC free article] [PubMed]
-
Hasty D. L., Itzhak O., Courtney H. S., Doyle R. J. Minireview: multiple adhesions of streptococci. Infection and Immunity. 1992;60:2147–2152. [PMC free article] [PubMed]
-
Hook E. W., Hooton T. M., Horton C. A., Coyle M. B., Ramsey P. G., Turck M. Microbiologic evaluation of cutaneous cellulitis in adults. Archives of Internal Medicine. 1986;146(2):295–297. [PubMed]
-
Howe P. M., Eduardo Fajardo J., Orcutt M. A. Etiologic diagnosis of cellulitis: comparison of aspirates obtained from the leading edge and the point of maximal inflammation. The Pediatric Infectious Disease Journal. 1987;6(7):685–686. [PubMed]
-
Jaffe J., Natanson-Yaron S., Caparon M. G., Hanski E. Protein F2, a novel fibronectin-binding protein from Streptococcus pyogenes, possesses two binding domains. Molecular Microbiology. 1996;21(2):373–384. [PubMed]
-
Ji Y., McLandsborough L., Kondagunta A., Cleary P. P. C5a peptidase alters clearance and trafficking of group A streptococci by infected mice. Infection and Immunity. 1996;64(2):503–510. [PMC free article] [PubMed]
-
Kaplan E. L., Wannamaker L. W. Suppression of the anti-streptolysin O response by cholesterol and by lipid extracts of rabbit skin. The Journal of Experimental Medicine. 1976;144(3):754–767. [PMC free article] [PubMed]
-
Kaplan E. L., Anthony B. F., Chapman S. S., Ayoub E. M., Wannamaker L. W. The influence of the site of infection on the immune response to group A streptococci. The Journal of Clinical Investigation. 1970;49(7):1405–1414. [PMC free article] [PubMed]
-
Kreikemeyer B., Talay S. R., Chhatwal G. S. Characterization of a novel fibronectin-binding surface protein in group A streptococci. Molecular Microbiology. 1995;17(1):137–145. [PubMed]
-
Kremer M., Zuckerman R., Avraham Z., Raz R. Long-term antimicrobial therapy in the prevention of recurrent soft-tissue infections. The Journal of Infection. 1991;22(1):37–40. [PubMed]
-
Lentnek A. L., Giger O., O'Rourke E. Group A beta-hemolytic streptococcal bacteremia and intravenous substance abuse. A growing clinical problem? Archives of Internal Medicine. 1990;150(1):89–93. [PubMed]
-
Levin J. C., Wessels M. R. Identification of csrR/csrS, a genetic locus that regulates hyaluronic acid capsule synthesis in group A streptococcus. Molecular Microbiology. 1998;30(1):209–219. [PubMed]
-
Lewis S. D., Peter G. S., Gómez-Marín O., Bisno A. L. Risk factors for recurrent lower extremity cellulitis in a U.S. Veterans Medical Center population. The American Journal of the Medical Sciences. 2006;332(6):304–307. [PubMed]
-
Li A., Wang N., Ge L., Xin H., Li W. Risk factors of recurrent erysipelas in adult Chinese patients: a prospective cohort study. BMC Infectious Diseases. 2021 January 7;21(1):26–32. [PMC free article] [PubMed]
-
Luk E. Y., Lo J. Y., Li A. Z., Lau M. C., Cheung T. K., Wong A. Y., et al. Tsang T. Scarlet fever epidemic, Hong Kong, 2011. Emerging Infectious Diseases. 2012;18(10):1658–1661. [PMC free article] [PubMed]
-
Martin J. M., Green M., Barbadora K. A., Wald E. R. Erythromycin-resistant group A streptococci in schoolchildren in Pittsburgh. The New England Journal of Medicine. 2002;346:1200–1206. [PubMed]
-
Mastro T. D., Farley T. A., Elliott J. A., Facklam R. R., Perks J. R., Hadler J. L., et al. Spika J. S. An outbreak of surgical-wound infections due to group A streptococcus carried on the scalp. The New England Journal of Medicine. 1990;323:968–972. [PubMed]
-
McIver K. S. Stand-alone response regulators controlling global virulence networks in streptococcus pyogenes. Contributions to Microbiology. 2009;16:103–119. [PubMed]
-
Mika A., Reynolds S. L., Pickering D., McMillan D., Sriprakash K. S., Kemp D. J., Fischer K. Complement inhibitors from scabies mites promote streptococcal growth--a novel mechanism in infected epidermis? PLoS Neglected Tropical Diseases. 2012;6(7):e1563. [PMC free article] [PubMed]
-
Mogielnicki N. P., Schwartzman J. D., Elliott J. A. Perineal group A streptococcal disease in a pediatric practice. Pediatrics. 2000;106(2 Pt 1):276–281. [PubMed]
-
Newell P. M., Norden C. W. Value of needle aspiration in bacteriologic diagnosis of cellulitis in adults. Journal of Clinical Microbiology. 1988;26(3):401–404. [PMC free article] [PubMed]
-
Ofek I., Beachey E. H., Jefferson W., Campbell G. L. Cell membrane-binding properties of group A streptococcal lipoteichoic acid. The Journal of Experimental Medicine. 1975;141(5):990–1003. [PMC free article] [PubMed]
-
Okada N., Liszewski M. K., Atkinson J. P., Caparon M. G. Membrane cofactor protein (CD46) is a keratinocyte receptor for the M protein of the group A streptococcus. Proceedings of the National Academy of Sciences of the United States of America. 1995;92(7):2489–2493. [PMC free article] [PubMed]
-
Okada N., Pentland A. P., Falk P., Caparon M. G. M protein and protein F act as important determinants of cell-specific tropism of Streptococcus pyogenes in skin tissue. The Journal of Clinical Investigation. 1994;94(3):965–977. [PMC free article] [PubMed]
-
Perez-Casal J., Caparon M. G., Scott J. R. Mry, a trans-acting positive regulator of the M protein gene of Streptococcus pyogenes with similarity to the receptor proteins of two-component regulatory systems. Journal of Bacteriology. 1991;173(8):2617–2624. [PMC free article] [PubMed]
-
Petersen J. P., Kaltoft M. S., Misfeldt J. C., Schumacher H., Schønheyder H. C. Community outbreak of perianal group A streptococcal infection in Denmark. The Pediatric Infectious Disease Journal. 2003;22(2):105–109. [PubMed]
-
Rocha C. L., Fischetti V. A. Identification and characterization of a novel fibronectin-binding protein on the surface of group A streptococci. Infection and Immunity. 1999;67(6):2720–2728. [PMC free article] [PubMed]
-
Roldan Y. B., Mata-Essayag S., Hartung C. Erysipelas and tinea pedis. Mycoses. 2000;43(5):181–183. [PubMed]
-
Semel J. D., Goldin H. Association of athlete's foot with cellulitis of the lower extremities: diagnostic value of bacterial cultures of ipsilateral interdigital space samples. Clinical Infectious Diseases. 1996;23(5):1162–1164. [PubMed]
-
Simon M. S., Cody R. L. Cellulitis after axillary lymph node dissection for carcinoma of the breast. The American Journal of Medicine. 1992;93(5):543–548. [PubMed]
-
Sjöblom A. C., Eriksson B., Jorup-Rönström C., Karkkonen K., Lindqvist M. Antibiotic prophylaxis in recurrent erysipelas. Infection. 1993;21(6):390–393. [PubMed]
-
Stevens, D. L. (2015). Infections of the Skin, Muscles, and Soft Tissues. In D. Kasper, A. Fauci, S. Hauser, D. Longo, J. Jameson, & J. Loscalzo, Harrison's Principles of Internal Medicine (19th ed., pp. 827-838). New York: McGraw Hill Education.
-
Stevens D. L., Bisno A. L., Chambers H. F., Dellinger E. P., Goldstein E. J., Gorbach S. L., et al. Infectious Diseases Society of America. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the. Clinical Infectious Diseases. 2014;59(2):e10–e52. [PubMed]
-
Stevens D. L., Bryant A. E., Goldstein E. J. Necrotizing Soft Tissue Infections. Infectious Disease Clinics of North America. 2021 March;35(1):135–155. [PubMed]
-
Talay S. R., Valentin-Weigand P., Jerlström P. G., Timmis K. N., Chhatwal G. S. Fibronectin-binding protein of Streptococcus pyogenes: Sequence of the binding domain involved in adherence of streptococci to epithelial cells. Infection and Immunity. 1992;60(9):3837–3844. [PMC free article] [PubMed]
-
Wang J. H., Liu Y. C., Cheng D. L., Yen M. Y., Chen Y. S., Wang J. H., et al. Lin H. H. Role of benzathine penicillin G in prophylaxis for recurrent streptococcal cellulitis of the lower legs. Clinical Infectious Diseases. 1997;25(3):685–689. [PubMed]
-
Wasserzug O., Valinsky L., Klement E., Bar-Zeev Y., Davidovitch N., Orr N., et al. Sarka S. A cluster of ecthyma outbreaks caused by a single clone of invasive and highly infective Streptococcus pyogenes. Clinical Infectious Diseases. 2009;48(9):1213–1219. [PubMed]
-
Wexler D. E., Chenoweth D. E., Cleary P. P. Mechanism of action of the group A streptococcal C5a inactivator. Proceedings of the National Academy of Sciences of the United States of America. 1985;82(23):8144–8148. [PMC free article] [PubMed]
-
Yang L. P., Keam S. J. Retapamulin: a review of its use in the management of impetigo and other uncomplicated superficial skin infections. Drugs. 2008;68(6):855–873. [PubMed]
-
York M. K., Gibbs L., Perdreau-Remington F., Brooks G. F. Characterization of antimicrobial resistance in Streptococcus pyogenes isolates from the San Francisco Bay area of northern California. Journal of Clinical Microbiology. 1999;37(6):1727–1731. [PMC free article] [PubMed]
-
Yun H. J., Lee S. W., Yoon G. M., Kim S. Y., Choi S., Lee Y. S., et al. Kim S. Prevalence and mechanisms of low- and high-level mupirocin resistance in staphylococci isolated from a Korean hospital. Journal of Antimicrobial Chemotherapy. 2003;51(3):619–623. [PubMed]
Dennis L. Stevens , PhD, MD e Amy E. Bryant , PhD.
Informazioni sull'autore e affiliazioni
Creato: 7 settembre 2022 ; Ultimo aggiornamento: 4 ottobre 2022
Except where otherwise noted, this work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License (CC-BY-NC-ND 4.0). To view a copy of this license, visit http://creativecommons.org/licenses/by-nc-nd/4.0/)


